Constante de equilibrio
La constante de equilibrio de una reacción química es el valor de su cociente de reacción cuando se alcanza un estado de equilibrio químico. En una reacción química reversible, cuando se alcanza el equilibrio, la velocidad de reacción en un sentido se iguala con la correspondiente velocidad de reacción que se da en sentido opuesto. La constante de equilibrio es el cociente de las constantes de velocidad de cada una de estas reacciones.
Para un conjunto dado de condiciones de reacción, la constante de equilibrio es independiente de las concentraciones analíticas iniciales del reactivo y las especies de productos en la mezcla. Por lo tanto, dada la composición inicial de un sistema, se pueden usar valores constantes de equilibrio conocidos para determinar la composición del sistema en equilibrio. Sin embargo, los parámetros de reacción como la temperatura, el disolvente y la fuerza iónica pueden influir en el valor de la constante de equilibrio.
El conocimiento de las constantes de equilibrio es esencial para la comprensión de muchos sistemas químicos, así como los procesos bioquímicos como el transporte de oxígeno por la hemoglobina en la sangre y la homeostasis ácido-base en el cuerpo humano.
Según el tipo de reacción química, la constante de equilibrio puede recibir diferentes nombre. Así, constantes de estabilidad, constantes de formación, constantes de unión, constantes de asociación y constantes de disociación son diferentes tipos de constantes de equilibrio.
Definiciones y propiedades básicas
[editar]Para un sistema que experimenta una reacción reversible descrita por la ecuación química general
una constante de equilibrio termodinámica, denotada por , se define como el valor del cociente de reacción Qt cuando las reacciones directa e inversa se producen a la misma velocidad. En el equilibrio químico, la composición química de la mezcla no cambia con el tiempo y el cambio de energía libre de Gibbs porque la reacción es cero. Si la composición de una mezcla en el equilibrio se cambia mediante la adición de algún reactivo, se alcanzará una nueva posición de equilibrio, con suficiente tiempo. Una constante de equilibrio está relacionada con la composición de la mezcla en equilibrio por[1][2]
donde {X} denota la actividad termodinámica del reactivo X en el equilibrio, [X] la concentración correspondiente y γ su coeficiente de actividad. Si se puede suponer que el cociente de coeficientes de actividad, , es constante en un rango de condiciones experimentales, como el pH, luego se puede derivar una constante de equilibrio como un cociente de concentraciones.
Una constante de equilibrio está relacionada con el cambio de energía libre estándar de Gibbs de la reacción por
donde R es la constante universal de los gases ideales, T es la temperatura absoluta (en kelvin) y ln es el logaritmo natural. Esta expresión implica que debe ser un número puro y no puede tener una dimensión, ya que los logaritmos solo se pueden tomar de números puros. también debe ser un número puro. Por otro lado, el cociente de reacción en equilibrio.
- .
tiene la dimensión de concentración elevada a algún poder. Dichos cocientes de reacción se denominan a menudo, en la literatura bioquímica, como constantes de equilibrio.
Para una mezcla de gases en equilibrio, una constante de equilibrio se puede definir en términos de presión parcial o fugacidad.
Una constante de equilibrio está relacionada con las constantes de velocidad hacia adelante y hacia atrás, kf y kr de las reacciones involucradas para alcanzar el equilibrio:
Tipos de constantes de equilibrio
[editar]Constantes sucesivas de formación y constantes globales
[editar]En la química de equilibrios de formación de complejos, se acepta que cada ligando se une al ion central de forma sucesiva, por lo que se considera que hay un equilibrio, con su correspondiente constante de equilibrio, para cada adición de ligando:[3]
Cada una de estas constantes recibe el nombre de constante de formación sucesiva. Igualmente, se acepta que existe una constante de formación global que se designa con el símbolo β y que tiene en cuenta el conjunto de los sucesivos equilibrios, como si estos se produjeran en un solo paso. Así, por ejemplo, la constante acumulativa para la formación del complejo genérico ML4 del ejemplo anterior, la constante global viene dada por:
También se puede escribir el equilibrio como la suma de las etapas individuales. Estas tienen constantes de formación acumulativas, que también se representan se símbolo βi y que, a veces, también reciben el nombre de constantes globales parciales, las cuales están relacionadas con las constantes sucesivas:[4]
Y en general, para un complejo con n ligandos :
Resultando que, si se observa atentamente las expresiones matemáticas anteriores, cada constante acumulativa, βi se relaciona con las anteriores mediante la expresión:
Una constante acumulativa siempre se puede expresar como el producto de constantes por pasos. No hay una notación acordada para las constantes por pasos, aunque un símbolo como KL
ML se encuentra a veces en la literatura. Siempre es mejor definir cada constante de estabilidad por referencia a una expresión de equilibrio.
Método de competencia
[editar]Un uso particular de una constante escalonada es en la determinación de valores constantes de estabilidad fuera del rango normal para un método dado. Por ejemplo, los complejos de EDTA de muchos metales están fuera del rango para el método potenciométrico. Las constantes de estabilidad para esos complejos se determinaron mediante la competencia con un ligando más débil.
La constante de formación de [Pd (CN)4]2− fue determinada por el método de competencia.
Constantes de asociación y disociación
[editar]En química orgánica y bioquímica, es habitual utilizar valores de pKa para los equilibrios de disociación ácida.
donde log denota un logaritmo a base 10 o logaritmo común, y Kdis es una constante de disociación ácida paso a paso. Para las bases, se usa la constante de asociación de bases, pKb. Para cualquier ácido o base dado, las dos constantes están relacionadas por pKa + pKb = pKw, por lo que pKa siempre puede usarse en los cálculos.
Por otro lado, las constantes de estabilidad para complejos metálicos y las constantes de enlace para complejo anfitrión-huésped generalmente se expresan como constantes de asociación. Al considerar equilibrios tales como
es habitual utilizar constantes de asociación tanto para ML como para HL. Además, en los programas informáticos generalizados que tratan con constantes de equilibrio, es una práctica general utilizar constantes acumulativas en lugar de constantes por pasos y omitir cargas iónicas de las expresiones de equilibrio. Por ejemplo, si NTA, ácido nitrilotriacético, N(CH2CO2H)3 se designa como H3L y forma complejos ML y MHL con un ion metálico M, las siguientes expresiones se aplicarían a las constantes de disociación.
Las constantes de asociación acumulativas se pueden expresar como
Observe cómo los subíndices definen la estequiometría del producto de equilibrio.
Microconstantes
[editar]Cuando dos o más sitios en una molécula asimétrica pueden estar involucrados en una reacción de equilibrio, hay más de una posible constante de equilibrio. Por ejemplo, la molécula L-DOPA tiene dos grupos hidroxilo no equivalentes que pueden desprotonarse. Denotando L -DOPA como LH2, el siguiente diagrama muestra todas las especies que pueden formarse (X= CH2CH(NH2)CO2H):
Las primeras constantes de protonación son
La concentración de LH- es la suma de las concentraciones de los dos micro-especies. Por lo tanto, la constante de equilibrio para la reacción, la macroconstante, es la suma de las microconstantes.
Del mismo modo,
Por último, la constante acumulativa es:
Así, aunque hay siete micro y macro constantes, solo tres de ellas son mutuamente independientes. Además, la constante de isomerización, Ki, es igual a la relación de los microconstantes.
En L -DOPA, la constante de isomerización es 0.9, por lo que las microespecies L1H y L2H tienen concentraciones casi iguales en todos los valores de pH.
En general, una macro-constante es igual a la suma de todas las micro-constantes y la ocupación de cada sitio es proporcional a la micro-constante. El sitio de protonación puede ser muy importante, por ejemplo, para la actividad biológica.
Las micro-constantes no pueden ser determinadas individualmente por los métodos usuales, que dan macro-constantes. Los métodos que se han utilizado para determinar las micro-constantes incluyen:
- bloqueando uno de los sitios, por ejemplo, por metilación de un grupo hidroxilo, para determinar una de las micro-constantes
- utilizando una técnica espectroscópica, como la espectroscopia infrarroja, donde las diferentes microespecies dan diferentes señales.
- Aplicando procedimientos matemáticos a 13C RMN.[5][6]
Consideraciones de pH (constantes de Brønsted)
[editar]El pH se define en términos de la actividad del ion hidrógeno.
En la aproximación del comportamiento ideal, la actividad es reemplazada por la concentración. El pH se mide por medio de un electrodo de vidrio, lo que puede generar una constante de equilibrio mixta, también conocida como constante de Brønsted.
Todo depende de si el electrodo está calibrado por referencia a soluciones de actividad conocida o concentración conocida. En este último caso, la constante de equilibrio sería un cociente de concentración. Si el electrodo se calibra en términos de concentraciones conocidas de iones de hidrógeno, sería mejor escribir p[H] en lugar de pH, pero esta sugerencia generalmente no se adopta.
Constantes de hidrólisis
[editar]En solución acuosa, la concentración del ion hidróxido está relacionada con la concentración del ion hidrógeno por
El primer paso en la hidrólisis de iones metálicos[7] se puede expresar de dos maneras diferentes
De ello se deduce que β* = KKW. Las constantes de hidrólisis generalmente se reportan en la forma β * y, por lo tanto, a menudo tienen valores mucho menores que 1. Por ejemplo, si log K = 4 y log KW = −14, log β* = 4 + (−14) = −10 así que β* = 10 −10. En general, cuando el producto de hidrólisis contiene n grupos hidróxido log β* = log K + n log KW
Constantes condicionales
[editar]Las constantes condicionales, también conocidas como constantes aparentes, son cocientes de concentración que no son verdaderas constantes de equilibrio pero que pueden derivarse de ellas.[8] Un ejemplo muy común es cuando el pH se fija en un valor particular. Por ejemplo, en el caso de hierro (III) que interactúa con EDTA, una constante condicional podría definirse por
Esta constante condicional variará con el pH. Tiene un máximo a un pH determinado. Ese es el pH donde el ligando secuestra el metal de manera más efectiva.
En bioquímica, las constantes de equilibrio a menudo se miden a un pH fijado por medio de una solución tampón. Dichas constantes son, por definición, condicionales y se pueden obtener valores diferentes cuando se utilizan diferentes buffers.
Equilibrios en fase gaseosa
[editar]Para los equilibrios en una fase gaseosa, la fugacidad, f, se usa en lugar de la actividad. Sin embargo, la fugacidad tiene la dimensión de la presión, por lo que debe dividirse por una presión estándar, generalmente 1 bar, para producir una cantidad adimensional, f /po. Una constante de equilibrio se expresa en términos de la cantidad adimensional. Por ejemplo, para el equilibrio de dimerización del dióxido de nitrógeno:
La fugacidad está relacionada con presión parcial, p, por un coeficiente de fugacidad sin dimensiones ϕ: f = ϕp . Así, para el ejemplo,
Por lo general, la presión estándar se omite en tales expresiones. Las expresiones para constantes de equilibrio en la fase gaseosa se asemejan a la expresión para equilibrios de solución con coeficiente de fugacidad en lugar de coeficiente de actividad y presión parcial en lugar de concentración.
Base termodinámica para expresiones constantes de equilibrio
[editar]El equilibrio termodinámico se caracteriza porque la energía libre para todo el sistema (cerrado) es un mínimo. Para sistemas a temperatura y presión constantes, la energía libre de Gibbs es mínima.[9] La pendiente de la energía libre de reacción con respecto a la coordenada de reacción, ξ, es cero cuando la energía libre está en su valor mínimo.
El cambio de energía libre, δGr, se puede expresar como una suma ponderada de potenciales químicos, las energías libres parciales de la especie en equilibrio. El potencial, μi, de la especie i en una reacción química es el derivado parcial de la energía libre con respecto al número de moles de esa especie, Ni
Un equilibrio químico general se puede escribir como
donde nj son los coeficientes estequiométricos de los reactivos en la ecuación de equilibrio, y mj son los coeficientes de los productos. En equilibrio
El potencial químico, μi, de la especie i puede calcularse en términos de su actividad, ai.
μ o
i es el potencial químico estándar de la especie, R es la constante de gas y T es la temperatura. Configuración de la suma de los reactivos j para que sea igual a la suma de los productos, k, de modo que rGr(Eq) = 0
Reorganizando los términos,
Esto se relaciona el cambio de energía libre de Gibbs estándar, ΔGo a una constante de equilibrio, K, el cociente de reacción de los valores de actividad en el equilibrio.
Equivalencia de expresiones termodinámicas y cinéticas para constantes de equilibrio
[editar]En el equilibrio, la velocidad de la reacción hacia adelante es igual a la velocidad de reacción hacia atrás. Una reacción simple, como la hidrólisis del éster.
tiene tasas de reacción dadas por expresiones
Según Guldberg y Waage, el equilibrio se alcanza cuando las tasas de reacción hacia adelante y hacia atrás son iguales entre sí. En estas circunstancias, una constante de equilibrio se define como igual a la relación de las constantes de velocidad de reacción hacia adelante y hacia atrás.
Por conveniencia, la concentración de agua puede tomarse como constante, lo que resulta en una expresión más simple
Este cociente de concentración particular, , tiene la dimensión de la concentración, pero la constante de equilibrio termodinámico, K, es siempre dimensional.
Valores desconocidos del coeficiente de actividad
[editar]
Es muy raro que los valores de los coeficientes de actividad se hayan determinado experimentalmente para un sistema en equilibrio. Hay tres opciones para tratar la situación en la que los valores de los coeficientes de actividad no se conocen a partir de mediciones experimentales.
- Utilice los coeficientes de actividad calculados, junto con las concentraciones de reactivos. Para los equilibrios en la solución, se pueden obtener estimaciones de los coeficientes de actividad de las especies cargadas utilizando la teoría de Debye-Hückel, una versión extendida o la teoría SIT. Para las especies no cargadas, el coeficiente de actividad γ0 generalmente sigue un modelo de "salting-out":
log10 γ0 = bI . donde "I" significa fuerza iónica.[10]
- Supongamos que los coeficientes de actividad son todos iguales a 1. Esto es aceptable en disoluciones muy diluidas, cuando todas las concentraciones son muy bajas.
- Para equilibrios en solución use un medio de alta fuerza iónica. En efecto, esto redefine el estado estándar como referente al medio. Los coeficientes de actividad en el estado estándar son, por definición, iguales a 1. El valor de una constante de equilibrio determinada de esta manera depende de la fuerza iónica. Cuando las constantes publicadas se refieren a una fuerza iónica diferente a la requerida para una aplicación particular, pueden ajustarse por medio de la teoría de iones específicos (SIT) y otras teorías.[11]
Dimensionalidad
[editar]Cualquier constante de equilibrio, K , debe ser adimensional. Una constante de equilibrio está relacionada con el cambio de energía libre estándar de Gibbs para la reacción por la expresión
Esto requiere que K sea un número puro del cual se pueda derivar un logaritmo. En el caso de un equilibrio simple.
la constante de equilibrio termodinámico se define en términos de las actividades, {AB}, {A} y {B}, de la especie en equilibrio entre sí.
Ahora, cada término de actividad se puede expresar como un producto de una concentración y un coeficiente de actividad correspondiente, . Por lo tanto,
Cuando cada coeficiente de actividad tiene la dimensión 1 / concentración, K permanece sin dimensiones. Sin embargo, cuando el coeficiente de coeficientes de actividad se establece en 1, K parece tener la dimensión de 1 / concentración.
Esto es lo que suele ocurrir en la práctica cuando una constante de equilibrio se calcula como un cociente de valores de concentración. El supuesto que subyace a esta práctica es que el cociente de actividades es constante en las condiciones en que se determina el valor constante de equilibrio. Normalmente, las condiciones se logran manteniendo la temperatura de reacción constante y utilizando un medio de fuerza iónica relativamente alta como disolvente. No es inusual, particularmente en textos relacionados con equilibrios bioquímicos, ver un valor citado con una dimensión. La justificación para esta práctica es que la escala de concentración utilizada puede ser mol dm−3 o mmol dm−3, de modo que la unidad de concentración debe establecerse para evitar que haya alguna ambigüedad.
En general, los equilibrios entre dos reactivos se pueden expresar como
en cuyo caso la constante de equilibrio se define, en términos de valores de concentración numéricos, como
La dimensión aparente de este valor K es la concentración 1−p−q; esto puede escribirse como M (1−p−q) o mM (1−p−q) , donde el símbolo M significa una concentración molar ( 1 M = 1 mol dm−3)
Otra complicación surge del hecho de que una constante de equilibrio puede definirse como una constante de asociación o como una constante de disociación. Para constantes de disociación.
- ;
La dimensión aparente asociada con una constante de disociación es el recíproco de la dimensión asociada con la constante de asociación correspondiente.
Escalas de concentración
[editar]Cuando las concentraciones se expresan en la escala de fracciones molares, todos los términos en la expresión
- Son números puros, por lo que no hay problema con respecto a la dimensionalidad. Sin embargo, es una práctica habitual medir concentraciones en solución en la escala de mol dm −3. En ese caso, el cociente parece tener la dimensión de dm³ mol−1. Por lo tanto, es necesario tener en cuenta la dimensionalidad al discutir la termodinámica de los equilibrios químicos. Hay dos enfoques posibles.
- Establezca la dimensión de Γ para que sea el recíproco de la dimensión del cociente de concentración. Esta es una práctica casi universal en el campo de las determinaciones constantes de estabilidad. La "constante de equilibrio" , es adimensional. Será una función de la fuerza iónica del medio utilizado para la determinación. Sin embargo, este proceso es inconsistente con la teoría de Debye-Hückel, donde , etc. se toman como números puros. El valor numérico de Γ puede ser designado como 1. Esto es equivalente a redefinir los estados estándar. Con esta convención .
- Reemplace cada término de concentración por el cociente adimensional , donde es la concentración del reactivo X en su estado estándar. Por definición el valor numérico de es 1, por lo que Γ también tiene un valor numérico de 1.
En ambos enfoques, el valor numérico de la constante de estabilidad no se modifica. El primero es más útil para propósitos prácticos; de hecho, la unidad del cociente de concentración a menudo se adjunta a un valor constante de estabilidad publicado en la literatura bioquímica. El segundo enfoque es consistente con la exposición estándar de la teoría de Debye-Hückel.
Agua como reactivo y disolvente
[editar]Para reacciones en solución acuosa, como una reacción de disociación ácida.
la concentración de agua puede tomarse como constante y la formación del ion hidronio, lo que implícita que:
La concentración de agua se omite en las expresiones que definen las constantes de equilibrio, excepto cuando las soluciones están muy concentradas.
- En este caso, K se define como una constante de disociación que en este caso concreto se denominaría constante de disociación ácida o constante de acidez (Ka).
Consideraciones similares se aplican a las reacciones de hidrólisis de iones metálicos.
Entalpía y entropía: dependencia de la temperatura
[editar]Si tanto la constante de equilibrio, y el cambio de entalpía estándar, para que una reacción se haya determinado experimentalmente, el cambio de entropía estándar para la reacción se deriva fácilmente. Ya que y
Para una primera aproximación, el cambio de entalpía estándar es independiente de la temperatura. Usando esta aproximación, integración definida de la ecuación de van't Hoff
da[12]
Esta ecuación se puede usar para calcular el valor del log K a una temperatura, T2, conociendo el valor a la temperatura T1.
La ecuación de van't Hoff también muestra que, para una reacción exotérmica ( ), cuando aumenta la temperatura, K disminuye y cuando disminuye la temperatura K aumenta, de acuerdo con el principio de Le Chatelier. Lo contrario se aplica cuando la reacción es endotérmica.
Cuando K se ha determinado a más de dos temperaturas, se puede aplicar un procedimiento de ajuste de línea recta a una gráfica de en contra para obtener un valor para . La teoría de propagación de errores se puede utilizar para demostrar que, con este procedimiento, el error en el cálculo el valor es mucho mayor que el error en los valores K de registro individuales. En consecuencia, K debe ser determinado a alta precisión cuando se utiliza este método. Por ejemplo, con un electrodo selectivo de iones de plata, cada valor de log K se determinó con una precisión de aprox. 0.001 y el método fue aplicado exitosamente.[13]
Los argumentos termodinámicos estándar pueden usarse para mostrar que, más generalmente, la entalpía cambiará con la temperatura.
donde Cp es la capacidad calorífica a presión constante.
Una formulación más compleja
[editar]El cálculo de K a una temperatura particular de un K conocido a otra temperatura dada se puede abordar de la siguiente manera si se dispone de propiedades termodinámicas estándar. El efecto de la temperatura en la constante de equilibrio es equivalente al efecto de la temperatura en la energía de Gibbs porque:
donde Δr Go es la energía de Gibbs estándar de reacción, que es la suma de las energías de Gibbs estándar de los productos de reacción menos la suma de las energías de Gibbs estándar de reactivos.
Aquí, el término "estándar" denota el comportamiento ideal (es decir, una dilución infinita) y una concentración estándar hipotética (típicamente 1 mol / kg). No implica ninguna temperatura o presión en particular porque, aunque contrariamente a la recomendación de la IUPAC, es más conveniente cuando se describen sistemas acuosos en amplios rangos de temperatura y presión.[14]
La energía estándar de Gibbs (para cada especie o para la reacción completa) se puede representar (a partir de las definiciones básicas) como:
En la ecuación anterior, el efecto de la temperatura en la energía de Gibbs (y por lo tanto en la constante de equilibrio) se atribuye por completo a la capacidad térmica. Para evaluar las integrales en esta ecuación, se debe conocer la forma de la dependencia de la capacidad calorífica de la temperatura.
Si la capacidad calorífica molar estándar es Co
p
puede ser aproximado por alguna función analítica de la temperatura (por ejemplo, la ecuación de Shomate), luego las integrales involucradas en el cálculo de otros parámetros pueden resolverse para producir expresiones analíticas para ellos. Por ejemplo, usando aproximaciones de las siguientes formas:[15]
- Para sustancias puras (sólidos, gases, líquidos):
- Para especies iónicas a T < 200 °C :
luego se pueden evaluar las integrales y se obtiene la siguiente forma final:
Las constantes A, B, C, a, b y la entropía absoluta, S̆ o
298 K , requerido para la evaluación de C o
p (T), así como los valores de G 298 K y S 298 K para muchas especies están tabuladas en la literatura.
Dependencia de la presión
[editar]La dependencia de la presión de la constante de equilibrio es generalmente débil en el rango de presiones que normalmente se encuentran en la industria, y por lo tanto, generalmente se descuida en la práctica. Esto es cierto para los reactivos/productos condensados (es decir, cuando los reactivos y productos son sólidos o líquidos), así como los gaseosos.
Para un ejemplo de reacción gaseosa, se puede considerar la reacción bien estudiada del hidrógeno con nitrógeno para producir amoníaco:
Si se aumenta la presión mediante la adición de un gas inerte, entonces ni la composición en equilibrio ni la constante de equilibrio se ven afectadas de manera apreciable (porque las presiones parciales permanecen constantes, suponiendo un comportamiento del gas ideal de todos los gases involucrados). Sin embargo, la composición en equilibrio dependerá apreciablemente de la presión cuando:
- la presión se cambia por compresión del sistema de reacción gaseoso, y
- La reacción da como resultado el cambio del número de moles de gas en el sistema.
En el ejemplo de reacción anterior, el número de moles cambia de 4 a 2, y un aumento de la presión por la compresión del sistema dará como resultado un aumento apreciable de amoniaco en la mezcla de equilibrio. En el caso general de una reacción gaseosa:
El cambio de la composición de la mezcla con la presión se puede cuantificar usando:
donde p denota las presiones parciales de los componentes, P es la presión total del sistema, X denota la fracción molar, K p es la constante de equilibrio expresada en términos de presiones parciales y K X es la constante de equilibrio expresada en términos de fracciones molares.
El cambio anterior en la composición está de acuerdo con el principio de Le Chatelier y no implica ningún cambio de la constante de equilibrio con la presión total del sistema. De hecho, para reacciones de gases ideales, K p es independiente de la presión.[16]
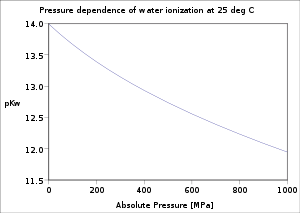
En una fase condensada, la dependencia de la presión de la constante de equilibrio se asocia con el volumen molar de reacción.[17] Para la reacción:
el volumen molar de reacción es:
donde V̄ denota un volumen molar parcial de un reactivo o un producto.
Para la reacción anterior, se puede esperar que el cambio de la constante de equilibrio de la reacción (basada ya sea en la fracción molar o en la escala de concentración molar) con presión a temperatura constante sea:
La materia es complicada ya que el volumen molar parcial depende de la presión.
Efecto de la sustitución isotópica
[editar]La sustitución isotópica puede provocar cambios en los valores de las constantes de equilibrio, especialmente si el hidrógeno se reemplaza por deuterio (o tritio).[18] Este efecto de isótopo de equilibrio es análogo al efecto de isótopo cinético en las constantes de velocidad, y se debe principalmente al cambio en la energía vibratoria de punto cero de los enlaces H – X debido al cambio de masa en la sustitución isotópica.[18] La energía del punto cero es inversamente proporcional a la raíz cuadrada de la masa del átomo de hidrógeno vibrante y, por lo tanto, será más pequeña para un enlace D – X que para un enlace H – X.
Un ejemplo es una reacción de abstracción del átomo de hidrógeno R '+ H – R ![]() R'– H + R con una constante de equilibrio KH, donde R' y R son radicales orgánicos, de manera que R 'forma un enlace más fuerte con el hidrógeno que R. la disminución de la energía del punto cero debido a la sustitución de deuterio será más importante para R'– H que para R – H, y R'– D se estabilizará más que R – D, de modo que la constante de equilibrio K D para R ' + D – R
R'– H + R con una constante de equilibrio KH, donde R' y R son radicales orgánicos, de manera que R 'forma un enlace más fuerte con el hidrógeno que R. la disminución de la energía del punto cero debido a la sustitución de deuterio será más importante para R'– H que para R – H, y R'– D se estabilizará más que R – D, de modo que la constante de equilibrio K D para R ' + D – R ![]() R'– D + R es mayor que KH. Esto se resume en la regla de que el átomo más pesado favorece al enlace más fuerte.[18]
R'– D + R es mayor que KH. Esto se resume en la regla de que el átomo más pesado favorece al enlace más fuerte.[18]
Se producen efectos similares en la solución para las constantes de disociación ácidas (K a ) que describen la transferencia de H+ o D+ de un ácido acuoso débil a una molécula de disolvente: HA + H2O = H3O+ + A- o DA + D2O ![]() D3O+ + A-. El ácido deuterado se estudia en agua pesada, ya que si se disolviera en agua ordinaria, el deuterio se intercambiaría rápidamente con hidrógeno en el disolvente.[18]
D3O+ + A-. El ácido deuterado se estudia en agua pesada, ya que si se disolviera en agua ordinaria, el deuterio se intercambiaría rápidamente con hidrógeno en el disolvente.[18]
La especie de producto H3O+ (o D3O+) es un ácido más fuerte que el ácido soluto, por lo que se disocia más fácilmente y su enlace H – O (o D – O) es más débil que el H – A (o D – A) Enlace del ácido soluto. La disminución en la energía del punto cero debido a la sustitución isotópica es, por lo tanto, menos importante en D3O+ que en DA, por lo que KD <KH , y el ácido deuterado en D2O es más débil que el ácido no deuterado en H2O. En muchos casos, la diferencia de las constantes logarítmicas pK D - pKH es aproximadamente 0.6,[18] modo que el pD correspondiente al 50% de disociación del ácido deuterado es aproximadamente 0.6 unidades más alto que el pH para el 50% de disociación de los ácidos no deuterados.
Véase también
[editar]- Determinación de constantes de equilibrio
- Constantes de estabilidad de complejos
- Fraccionamiento de equilibrio
- Química del equilibrio
Referencias
[editar]- ↑ Libro de Oro IUPAC .
- ↑ Rossotti, F. J. C.; Rossotti, H. (1961). The Determination of Stability Constants. McGraw-Hill. p. 5.
- ↑ Harris, Daniel C. (1992). «Cap. 5-5 Formación de complejos». Análisis Químico Cuantitativo. Grupo Editorial Iberoamericana. pp. 76-79. ISBN 970-625-003-4.
- ↑ Douglas A. Skoog, Donald M. West, F. James Holler and Stanley R. Crouch. (2015). «Cap. 17A.1 Equilibrio de formación de complejos». Fundamentos de química analítica. Cengage Learning. p. 402. ISBN 978-607-519-937-6.
- ↑ Hague, David N.; Moreton, Anthony D. (1994). «Protonation sequence of linear aliphatic polyamines by 13C NMR spectroscopy». J. Chem. Soc., Perkin Trans. 2 (2): 265-70. doi:10.1039/P29940000265.
- ↑ Borkovec, Michal; Koper, Ger J. M. (2000). «A Cluster Expansion Method for the Complete Resolution of Microscopic Ionization Equilibria from NMR Titrations». Anal. Chem. 72 (14): 3272-9. PMID 10939399. doi:10.1021/ac991494p.
- ↑ Baes, C. F.; Mesmer, R. E. (1976). The Hydrolysis of Cations. Wiley.[página requerida]
- ↑ Schwarzenbach, G.; Flaschka, H. (1969). Complexometric titrations. Methuen.[página requerida]
- ↑ Denbigh, K. (1981). «Chapter 4». The principles of chemical equilibrium (4th edición). Cambridge: Cambridge University Press. ISBN 978-0-521-28150-8.
- ↑ Butler, J. N. (1998). Ionic Equilibrium. John Wiley and Sons.
- ↑ «Project: Ionic Strength Corrections for Stability Constants». International Union of Pure and Applied Chemistry. Archivado desde el original el 29 de octubre de 2008. Consultado el 23 de noviembre de 2008.
- ↑ Atkins, Peter; de Paula, Julio (2006). Physical Chemistry. Oxford. p. 214. ISBN 978-0198700722.
- ↑ Barnes, D.S.; Ford, G.J; Pettit, L.D.; Sherringham, C. (1971). «Ligands containing elements of group VIB. Part V. Thermodynamics of silver complex formation of some saturated and unsaturated (alkyl-thio)acetic and (alkylseleno)acetic acids». J. Chem. Soc. A: 2883-2887. doi:10.1039/J19710002883.
- ↑ Majer, V.; Sedelbauer, J.; Wood (2004). «Calculations of standard thermodynamic properties of aqueous electrolytes and nonelectrolytes». En Palmer, D. A., ed. Aqueous Systems at Elevated Temperatures and Pressures: Physical Chemistry of Water, Steam and Hydrothermal Solutions. Elsevier.[página requerida]
- ↑ Roberge, P. R. (November 2011). «Appendix F». Handbook of Corrosion Engineering. McGraw-Hill. p. 1037ff.
- ↑ Atkins, P. W. (1978). Physical Chemistry (6th edición). Oxford University Press. p. 210.
- ↑ Van Eldik, R.; Asano, T.; Le Noble, W. J. (1989). «Activation and reaction volumes in solution. 2». Chem. Rev. 89 (3): 549-688. doi:10.1021/cr00093a005.
- ↑ a b c d e Laidler K.J. Chemical Kinetics (3rd ed., Harper & Row 1987), p.428–433 ISBN 0-06-043862-2
Fuentes de datos
[editar]- IUPAC SC-Database Archivado el 19 de junio de 2017 en Wayback Machine. Una base de datos completa de datos publicados sobre constantes de equilibrio de complejos metálicos y ligandos
- NIST Standard Reference Database 46 Archivado el 5 de julio de 2010 en Wayback Machine. : Constantes de estabilidad de complejos metálicos seleccionadas críticamente
- Ácidos y bases inorgánicos y orgánicos p K a datos en agua y DMSO
- Página web de la Base de datos termodinámica Glenn de la NASA con enlaces a calor, entalpía y entropía específicos dependientes de la temperatura (auto-consistentes) para elementos y moléculas Archivado el 22 de enero de 2017 en Wayback Machine.
Enlaces externos
[editar]- Science Aid: Equilibrium Constants Explicación de K c y K p para nivel de escuela secundaria





![{\displaystyle K^{\ominus }={\frac {\mathrm {\{R\}} ^{\rho }\mathrm {\{S\}} ^{\sigma }...}{\mathrm {\{A\}} ^{\alpha }\mathrm {\{B\}} ^{\beta }...}}={\frac {{[\mathrm {R} ]}^{\rho }{[\mathrm {S} ]}^{\sigma }...}{{[\mathrm {A} ]}^{\alpha }{[\mathrm {B} ]}^{\beta }...}}\times \Gamma ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/97bbd89a5f9a7b10aca1ae7191ba1228f4b5b112)


![{\displaystyle K_{c}=K^{\ominus }/\Gamma ={\frac {[\mathrm {R} ]^{\rho }[\mathrm {S} ]^{\sigma }...}{[\mathrm {A} ]^{\alpha }[\mathrm {B} ]^{\beta }...}}.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6379f8a8565fe07860036bdbd906553fe1e2a298)



![{\displaystyle {\frac {[\mathrm {R} ]^{\rho }[\mathrm {S} ]^{\sigma }...}{[\mathrm {A} ]^{\alpha }[\mathrm {B} ]^{\beta }...}}(eq)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/908336ba939b8ad5e9c7d0bd786b19c7607170d5)

![{\displaystyle {\ce {M + L <=>[K_1] ML}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b13c63c3ec060bdb4fb84c13c1e79ede251999b1)
![{\displaystyle K_{1}={\frac {[ML]}{[M][L]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4dbbfe6358739be497e7fbe89291bd029387988)
![{\displaystyle {\ce {ML + L <=>[K_2] ML2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/38756942a97053d48c12e8f67331d9f64caf6e24)
![{\displaystyle K_{2}={\frac {[ML_{2}]}{[ML][L]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45ad86aeca865d3eb8bacd1df9463510b15db1b9)
![{\displaystyle {\ce {ML_2 + L <=>[K_3] ML3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d0b99561b86a68242d051b621c9c99378f2249da)
![{\displaystyle K_{3}={\frac {[ML_{3}]}{[ML_{2}][L]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63c183e860966190403816fd7784e092b250a202)
![{\displaystyle {\ce {ML3 + L <=>[K_4] ML4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45d1ee3abf458f0216ca96bc567de28b3390d0c8)
![{\displaystyle K_{4}={\frac {[ML_{4}]}{[ML_{3}][L]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ef9d136db3e427a6bf317526d3c086736f2e0ed)

![{\displaystyle \beta _{4}={\frac {[ML_{4}]}{[M][L]^{4}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8994fd9c31f2ace4d206763ace0eb29ae31cac06)

![{\displaystyle \beta _{1}={\frac {[ML]}{[M][L]}}=K_{1}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/dacf527dacde8390f18260b1bba13dc5dc2e4b4f)

![{\displaystyle \beta _{2}={\frac {[ML_{2}]}{[M][L]^{2}}}=K_{1}.K_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58b0adb76b236e3bb3ce5ebceade395050b03328)

![{\displaystyle \beta _{3}={\frac {[ML_{3}]}{[M][L]^{3}}}=K_{1}.K_{2}.K_{3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/41ae96148f77c27463b95f07e17dfcd4c958895b)
![{\displaystyle \beta _{4}={\frac {[ML_{4}]}{[M][L]^{4}}}=K_{1}.K_{2}.K_{3}.K_{4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bb93ec717775a8481f6b82c926381294f8c865b)

![{\displaystyle \beta _{n}={\frac {[ML_{n}]}{[M][L]^{n}}}=K_{1}.K_{2}.K_{3}...K_{n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b88ea7a6842900bdd187b25188f775897132ae89)


![{\displaystyle [\mathrm {ML} ']=K{\frac {[\mathrm {ML} ][\mathrm {L} ']}{[\mathrm {L} ]}}=K{\frac {\beta _{\mathrm {ML} }[\mathrm {M} ][\mathrm {L} ][\mathrm {L} ']}{[\mathrm {L} ]}}=K\beta _{\mathrm {ML} }[\mathrm {M} ][\mathrm {L} '];\quad \beta _{\mathrm {ML} '}=K\beta _{\mathrm {ML} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d05c614f8ba11ecb1406d6e9da06a9ba14c52c8)


![{\displaystyle {\begin{array}{ll}{\ce {H3L <=> {H2L}+ H}};&{\ce {p}}K_{1}=-\log \left({\frac {[{\ce {H2L}}][{\ce {H}}]}{[{\ce {H3L}}]}}\right)\\{\ce {H2L <=> {HL}+ H}};&{\ce {p}}K_{2}=-\log \left({\frac {[{\ce {HL}}][{\ce {H}}]}{[{\ce {H2L}}]}}\right)\\{\ce {HL <=> {L}+ H}};&{\ce {p}}K_{3}=-\log \left({\frac {[{\ce {L}}][{\ce {H}}]}{[{\ce {HL}}]}}\right)\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2fe45058f5eb3d3c3bb1958a3e9aabdb1cad2f2f)
![{\displaystyle {\begin{array}{ll}{\ce {{L}+ H <=> HL}};&\log \beta _{011}=\log \left({\frac {[{\ce {HL}}]}{[{\ce {L}}][{\ce {H}}]}}\right)={\ce {p}}K_{3}\\{\ce {{L}+ 2H <=> H2L}};&\log \beta _{012}=\log \left({\frac {[{\ce {H2L}}]}{[{\ce {L}}][{\ce {H}}]^{2}}}\right)={\ce {p}}K_{3}+{\ce {p}}K_{2}\\{\ce {{L}+ 3H <=> H3L}};&\log \beta _{013}=\log \left({\frac {[{\ce {H3L}}]}{[{\ce {L}}][{\ce {H}}]^{3}}}\right)={\ce {p}}K_{3}+{\ce {p}}K_{2}+{\ce {p}}K_{1}\\{\ce {{M}+ L <=> ML}};&\log \beta _{110}=\log \left({\frac {[{\ce {ML}}]}{[{\ce {M}}][{\ce {L}}]}}\right)\\{\ce {{M}+ {L}+ H <=> MLH}};&\log \beta _{111}=\log \left({\frac {[{\ce {MLH}}]}{[{\ce {M}}][{\ce {L}}][{\ce {H}}]}}\right)\end{array}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/87e8eda75f4bbf3d8d3a13d285a53c5f29022213)

![{\displaystyle [L^{1}H]=k_{11}[L][H]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f682fbc65622325bc8abd12054667a1c643da54f)
![{\displaystyle [L^{2}H]=k_{12}[L][H]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4609bbfadf5ea91ad407273df771b1b4162a43d1)






![{\displaystyle \mathrm {p} K=-\log \left({\frac {[\mathrm {L} ]\{\mathrm {H} \}}{[\mathrm {HL} ]}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d2e6c9a676961a7d6434161b8c39b0881dc7411a)
![{\displaystyle {\ce {{\mathit {K}}_{W}=[H][OH]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9faddc62b25f1a8557d5d72c17cb8ac46b3095d9)
![{\displaystyle {\ce {[OH]={\mathit {K}}_{W}[H]^{-1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45481f84a02758d3c3f2b96a4b132bce158d96c2)
![{\displaystyle {\begin{cases}{\ce {M(H2O) <=> {M(OH)}+ H}};&[{\ce {M(OH)}}]=\beta ^{*}[{\ce {M}}][{\ce {H}}]^{-1}\\{\ce {{M}+ OH <=> M(OH)}};&[{\ce {M(OH)}}]=K[{\ce {M}}][{\ce {OH}}]=KK_{{\ce {W}}}[{\ce {M}}][{\ce {H}}]^{-1}\end{cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d902ebd08f7a075b8e7f1d7aebe20dd0fd86dc6a)
![{\displaystyle K_{\mathrm {cond} }={\frac {[{\mbox{Fe total unido al EDTA}}]}{[{\mbox{Fe total no unido al EDTA}}]\times [{\mbox{EDTA total no unido al Fe}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/47d4421765d9a06fd2eaafac1f959254a139ed03)















![{\displaystyle {\begin{cases}{\text{tasa de avance}}=k_{f}{\ce {[AB][H2O]}}\\{\text{tasa de retroceso}}=k_{b}{\ce {[AH][B(OH)]}}\end{cases}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cf9b4c472207ea17e274d2b2809f41ed6883a58a)
![{\displaystyle K={\frac {k_{f}}{k_{b}}}={\frac {{\ce {[AH][B(OH)]}}}{{\ce {[AB][H2O]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/29ed8c668a2ca8b82e92d079faeeea81f42c693b)
![{\displaystyle K^{c}={\frac {{\ce {[AH][B(OH)]}}}{{\ce {[AB]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/88bdd5add8ce02f4f3f13912ca0e8024708ec4cb)




![{\displaystyle [X]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fadb3aef0836cb1d004479f470703a45972bf8fe)

![{\displaystyle K={\frac {[AB]}{[A][B]}}\times {\frac {\gamma (AB)}{\gamma (A)\gamma (B)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c65499560cc2e7395192e99681313beecd8fef5)
![{\displaystyle K={\frac {[AB]}{[A][B]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8041af2f31e992a0663492c5aae39a422c5caac1)

![{\displaystyle K={\frac {[{\ce {A}}_{p}{\ce {B}}_{q}]}{[{\ce {A}}]^{p}[{\ce {B}}]^{q}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/939aa48ad641483471c425ed10e4f18c6bcd5b59)

![{\displaystyle K={\frac {[{\ce {A}}]^{p}[{\ce {B}}]^{q}}{[{\ce {A}}_{p}{\ce {B}}_{q}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/43506c890ad5f61509994f356dfea994ef5517bb)
![{\displaystyle K={\frac {[AB]}{[A][B]}}\times {\frac {\gamma (AB)}{\gamma (A)\gamma (B)}}={\frac {[AB]}{[A][B]}}\times \Gamma }](https://wikimedia.org/api/rest_v1/media/math/render/svg/126ab070481302044197cbd913f8fe6bd34749e9)
![{\displaystyle {\frac {[AB]}{[A][B]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5a6b465c52e2003713b2f6f65cafafd2edb43b6c)



![{\displaystyle {\frac {[X]}{[X^{0}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6927ad27387845e0bd8ffbe6ec6dd4e2a4c3c51a)
![{\displaystyle [X^{0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9218daa96faf3c4ac4d9a1e6c9fb3c14577e72e)



![{\displaystyle K={\frac {[A][H]}{[AH]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/da5bec204ec1316df7b4dc4d9b598adbaf17caed)





















